您现在的位置是: 首页 > 教育新闻 教育新闻
高考化学考什么卷-高考化学考什么
tamoadmin 2024-08-25 人已围观
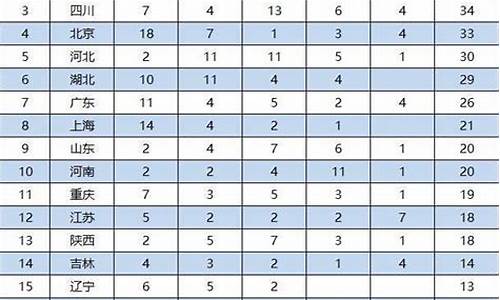
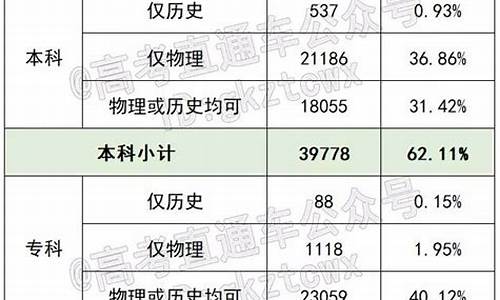
简介1.高考全国课标卷理综的物理化学分别考哪几本书?每本书或每块知识点各占多少分?2.四川高考甲卷化学考哪几本书3.高考化学大题常考知识点高考全国课标卷理综的物理化学分别考哪几本书?每本书或每块知识点各占多少分?一,物理:必考内容:物理1,质点的直线运动,相互作用与牛顿运动定律,物理2,机械能抛体运动与圆周运动,万有引力定律。选考内容:3-1电场,电路,磁场,3-2电磁感应,交变电流,3-5碰撞与动量
1.高考全国课标卷理综的物理化学分别考哪几本书?每本书或每块知识点各占多少分?
2.四川高考甲卷化学考哪几本书
3.高考化学大题常考知识点
高考全国课标卷理综的物理化学分别考哪几本书?每本书或每块知识点各占多少分?

一,物理:
必考内容:物理1,质点的直线运动,相互作用与牛顿运动定律,物理2,机械能抛体运动与圆周运动,万有引力定律。
选考内容:3-1电场,电路,磁场,3-2电磁感应,交变电流,3-5碰撞与动量守恒,原子结构原子核,波粒二象性,33-3分子动理论与统计观点固体、液体与气体,热力学定律与能量守恒3-4机械振动与机械波,电磁振荡与电磁波,光,相对论。
二,化学
必考内容涵盖必修模块“化学1”“化学2”和选修模块“化学反应原理”的内容。根
据化学的学科体系和学科特点,必考部分的内容包括:化学学科特点和基本研究方法、化学
基本概念和基本理论、常见无机物及其应用、常见有机物及其应用和化学实验基础五个方面。
选考内容为选修模块“物质结构与性质”和“有机化学基础”,考生从中任意选一个模
块考试。
扩展资料生物
生物学科的考试范围包括必考部分和选考部分,必考部分在课程标准必修模块的范围内,
选考部分在课程标准选修模块1(生物技术实践)和选修模块3(现代生物科技专题)的范围内。
必考部分的试题是考生必做的,选考部分的试题需要考生在规定的选考内容中选择。
生物学科的考试内容以知识内容表的形式呈现。知识内容要求掌握的程度,在知识内容
表中用Ⅰ和Ⅱ标出;实验内容要求掌握的程度则用文字说明。Ⅰ和Ⅱ的含义如下。
Ⅰ:对所列知识点要知道其含义,能够在试题所给予的相对简单的情境中识别和使用它们。
Ⅱ:理解所列知识和其他相关知识之间的联系和区别,并能在较复杂的情境中综合运用
其进行分析、判断、推理和评价。
参考资料来源?中国教育考试网-2018年考试大纲四川高考甲卷化学考哪几本书
必修一必修二选修四。
必考内容是必修一,必修二,选修四,选考内容是选修三,或选修五任选其一。化学想要及格好像都要学的,都学了都不一定及格别说你只学一部分了,化学很难的。高中化学一共是两本必修三本选修。必修一必修二选修四是高考必考教材,选修三和选修五高考时选考内容(两题中选一题做)。化学注意学必修一必修二选修四是重点难点一定要好好学。化学学科教材共包括必修1、必修2、选修3、选修4、选修5等5个部分的内容,各省区的学习和考试要求有所不同。
高考化学大题常考知识点
高考化学作为高中化学课程的一种特殊形式,大题有哪些常考的知识点呢?接下来我为你整理了,一起来看看吧。
:碳酸盐
1.一些碳酸盐的存在、俗称或用途。
大理石、石灰石、蛋壳、贝壳、钟乳石—CaCO3;纯碱、苏打—Na2CO3;
小苏打—NaHCO3可用于食品发泡,治疗胃酸过多症碳铵—NH4HCO3氮肥;
草木灰的主要成分—K2CO3钾肥;锅垢的主要成分—CaCO3和MgOH2;
制普通玻璃原料—石灰石、纯碱、石英;制水泥的原料—石灰石、粘土
2.碳酸的正盐和酸式盐
1、相互转化:碳酸钙和碳酸氢钙的转化实验现象;石灰岩洞和钟乳石形成
碳酸钠和碳酸氢钠的转化碳酸钠溶液跟盐酸反应不如碳酸氢钠剧烈;除去碳酸氢钠溶液中的碳酸钠杂质;除去碳酸钠中碳酸氢钠杂质;除去二氧化碳中的氯化氢杂质为什么不用碳酸钠溶液而用碳酸氢钠溶液等问题;在饱和碳酸钠溶液中通入二氧化碳气体,有碳酸氢钠析出的原因:①消耗了水②碳酸钠的溶解度大于碳酸氢钠③生成碳酸氢钠的质量大于原溶液中碳酸钠的质量
2、共同性质:都能跟酸比碳酸强的酸反应生成二氧化碳气体。碳酸盐的检验
3、稳定性比较:正盐比酸式盐稳定稳定性:酸<酸式盐<正盐,是一个比较普遍的现象
如HClO<CaClO2;H2SO3<Na2SO3等
碳酸氢钠受热的实验现象;碳酸氢钙溶液受热的实验现象
4、溶解性比较:一般说酸式盐的溶解性强于正盐如CaHCO32>CaCO3,反例:NaHCO3<Na2CO3
5、碳酸氢钠与碳酸钠某些反应的异同
①、都有碳酸盐的通性—-与盐酸反应生成二氧化碳要注意熟悉反应时耗酸量及生成气体量的各种情况下的比较。
②、跟石灰水或氢氧化钡溶液都生成白色沉淀;
③、碳酸氢钠能跟氢氧化钠等碱反应而碳酸钠不反应;
④、碳酸钠跟氯化钙或氯化钡溶液易生成碳酸盐沉淀,而碳酸氢钠跟盐类稀溶液不易生成沉淀。
:氯化氢与盐酸
1、浓盐酸被二氧化锰氧化实验室制氯气
2、盐酸、氯化钠等分别与硝酸银溶液的反应盐酸及氯化物溶液的检验;溴化物、碘化物的检验
3、盐酸与碱反应
4、盐酸与碱性氧化物反应
5、盐酸与锌等活泼金属反应
6、盐酸与弱酸盐如碳酸钠、硫化亚铁反应
7、盐酸与苯酚钠溶液反应
8、稀盐酸与漂反应
9、氯化氢与乙烯加成反应
10、氯化氢与乙炔加成反应制聚氯乙烯
11、漂与空气中的二氧化碳反应说明碳酸酸性强于HClO
12、HF、HCl、HBr、HI酸性的比较HF为弱酸,HCl、HBr、HI为强酸,且酸性依次增强
13、用于人工降雨的物质有哪些?干冰、AgI
:一些常见物质的成分
1.漂有效成分CaClO2,非有效成分CaCl22.黄铁矿FeS2;3.黑火药C,KNO3,S;
4.明矾KAlSO42?12H2O;5.绿矾FeSO4?7H2O;6.蓝矾胆矾CuSO4?5H2O;7.重晶石BaSO4
8.纯碱、苏打Na2CO3;9小苏打NaHCO3;10生石灰CaO;11熟石灰、消石灰CaOH
2;12.石灰石,大理石CaCO3;13王水浓硝酸浓盐酸1∶3;14.石英.水晶矽石SiO2;15.刚玉Al2O3;
16.锅垢CaCO3和MgOH2;17.铁红,赤铁矿Fe2O318.磁性氧化铁,磁铁矿Fe3O4;19.铅笔芯材料—粘土和石墨;
20.煤—有机物和无机物组成的复杂混合物;21.石油—主要由烷烃,环烷烃,芳香烃组成的复杂混合物
22.沼气,天然气CH4;23碱石灰CaO,NaOH;24氯仿CHCl3;24.电石CaC2;25.甘油—丙三醇;
26.石炭酸—苯酚;27.福尔马林--甲醛溶液;28.肥皂—高阶脂肪酸的钠盐
:硫单质及其化合物
一硫单质的反应非金属性弱于卤素、氧和氮
1.硫与氧气反应只生成二氧化硫,不生成三氧化硫
2.硫与氢气加热反应
3.硫与铜反应生成+1价铜化合物,即硫化亚铜
4.硫与铁反应,生成+2价铁化合物,即硫化亚铁
5.硫与汞常温反应,生成HgS撒落后无法收集的汞珠应撒上硫粉,防止汞蒸气中毒
7.硫与强碱溶液反应生成硫化物和亚硫酸盐试管上粘附的硫除了可用CS2洗涤以外,还可以
用NaOH溶液来洗3S+6NaOH=2Na2S+Na2SO3+3H2O
二二氧化硫或亚硫酸的反应弱氧化性,强还原性,酸性氧化物
1.氧化硫化氢
2.被氧气氧化工业制硫酸时用催化剂;空气中的二氧化硫在某些悬浮尘埃和阳光作用下被氧气
氧化成三氧化硫,并溶解于雨雪中成为酸性降水。
3被卤素氧化SO2+Cl2+2H2O==H2SO4+2HCl
4.与水反应
5.与碱性氧化物反应
6.与碱反应
7.有漂白性与有机色质化合成无色物质,生成的无色物质不太稳定,受热或时日一久便返色
三硫酸性质用途小结
1.强酸性
1、与碱反应
2、与碱性氧化物反应除锈;制硫酸铜等盐
3、与弱酸盐反应制某些弱酸或酸式盐
4、与活泼金属反应制氢气
2.浓硫酸的吸水性作气体干燥剂;
3.浓硫酸的脱水性使木条、纸片、蔗糖等炭化;乙醇脱水制乙烯
4.浓硫酸的强氧化性
1、使铁、铝等金属钝化;
2、与不活泼金属铜反应加热
3、与木炭反应加热
4、制乙烯时使反应混合液变黑
5.高沸点不挥发性制挥发性酸
1、制氯化氢气体
2、制硝酸HNO3易溶,用浓硫酸
实验室制二氧化碳一般不用硫酸,因另一反应物通常用块状石灰石,反应生成的硫酸钙溶解度
小易裹在表面阻碍反应的进一步进行。
6.有机反应中常用作催化剂
1、乙醇脱水制乙烯作催化剂兼作脱水剂,用多量浓硫酸,乙醇浓硫酸体积比1∶3
2、苯的硝化反应硫酸作催化剂也起吸水作用,用浓硫酸
3、酯化反应硫酸作催化剂和吸水剂,用浓硫酸
4、酯水解硫酸作催化剂,用稀硫酸
5、糖水解注意:检验水解产物时,要先加碱中和硫酸
7.硫酸的工业制备
“四个三”:三个阶段、三个装置、三个反应、三个原理:增大接触面积原理、热交换原理、逆流原理思考:工业制硫酸的条件如何选择?温度、压强用常压的原因、催化剂;从燃烧炉中出来的气体进入接触室前为什么要净化?