您现在的位置是: 首页 > 教育分析 教育分析
高考卷化学部分新课标1,高考小卷化学
tamoadmin 2024-05-20 人已围观
简介1.福建2023年高考化学难吗?2008北京 25(16分)菠萝酯是一种具有菠萝香气的食用香料,是化合物甲与苯氧乙酸发生化反应的产物。(1)甲一定含有的官能团的名称是____________________________________。 (2)5.8 g甲完全燃烧可产生0.3 mol CO2和0.3 mol H2O,甲蒸气对氢气的相对密度是29,甲分子中不含甲基,且为链状结构,其结构简式是
1.福建2023年高考化学难吗?
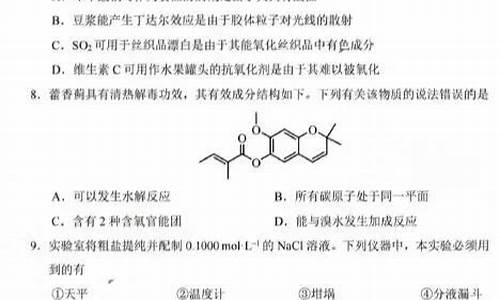
2008北京 25(16分)菠萝酯是一种具有菠萝香气的食用香料,是化合物甲与苯氧乙酸发生化反应的产物。
(1)甲一定含有的官能团的名称是____________________________________。
(2)5.8 g甲完全燃烧可产生0.3 mol CO2和0.3 mol H2O,甲蒸气对氢气的相对密度是29,甲分子中不含甲基,且为链状结构,其结构简式是_____________________________。
(3)苯氧乙酸有多种酯类的同分异构体,其中能与FeCl2溶液发生显色反应,且有2种一硝基取代物的同分异构体是(写出任意2种的结构简式)
_____________________________________________________。
(4)已知:
菠萝酯的合成路线如下:
①试剂X不可选用的是(选填字母)____________。
a.CH3COONa溶液 b.NaOH溶液 c.NaHCO3溶液 d.Na
②丙的结构简式是_________________,反应Ⅱ的反应类型是___________。
③反应Ⅳ的化学方程式是
_______________________________________________________________________。
25.(16分)
(1)羟基
(2)CH2=CH-CH2-OH
(3) (答对其中任意两个均给分)
(4)①a c
②ClCH2COOH取代反应
③
26.(3分)常状况下,X、Y和Z是三种气态单质。X的组成元素是第三周期原子半径最小的元素(稀有气体元素除外);Y和Z均由元素R组成,反应Y+2I-+2H+ I2+Z+H2O常作为Y的临定反应。
(1)Y与Z的关系是(选填字母)_______。
a.同位素 b.同系物 c.同素异形体 d.同分异构体
(2)将Y和二氧化硫分别通入品红溶液,都能使品红褪色。简述用褪色的溶液区别二者的实验方法_________________________________________________________________
________________________________________________________________________。
(3)举出实例说明X的氧化性比硫单质的氧化性强(用化学方程式表示)。
________________________________________________________________________。
(4)气体(CN)2与X化学性质相似,也能与H2反应生成HCN(其水溶液是一种酸)。
①HCN分子中含有4个共价键,其结构式是___________________________________。
②KCN溶液显碱性,原因是(用离子方程式表示)_____________________________。
(5)加热条件下,足量的Z与某金属M的盐MCR3(C为碳原素)完全反应生成CR2和MmRn(m、n均为正整数)。若CR2质量为 1g,MmRn质量为 2g,M的相对原子质量为a,则MmRn中m:n=_____________(用含 和a的代数式表示)。
26.(13分)
(1)c
(2)加热褪色后的溶液,若溶液恢复红色,则原通入气体为SO2;若溶液不变红,则原通入气体是O3
(3)2Fe+3Cl2 2FeCl3 Fe+S FeS(其他合理答案均给分)
(4)①H-C=N
②CN-+H2O HCN+OH-
(5)16
2009年北京
25.(16分)
丙烯可用于合成是杀除根瘤线虫的农药(分子式为 )和应用广泛的DAP树脂;
已知脂与酯克发生如下酯交换反应:
(R,R’ R’’代表羟基)
(1)农药 分子中每个碳原子上均连有卤原子。
①A的结构简式是
A 含有的官能团名称是 ;
②由丙烯生成A的反应类型是
(2)A水解可得到D,该水解反应的化学方程式是 。
(3)C蒸汽密度是相同状态下甲烷密度的6.25倍,C中各元素的质量分数分别为
碳60%,氢8%,氧32% ,C的结构简式是 。
(4)下列说法正确的是(选填序号字母)
a.能发生聚合反应,还原反应和氧化反应
b.C含有两个甲基的羧酸类同分异构体有4个
c D催化加氢的产物与B具有相同的相对分子质量
d E有芳香气味,易溶于乙醇
(5)E的水解产物经分离子最终的到甲醇和B,二者均可循环利用DAP树脂的制备。其中将甲醇与H分离的操作方法是
(6)F的分子式为 DAP单体为苯的二元取代物,且两个取代基部处于对位,
该单体苯环上的一溴取代物只有两种。D和F反应生成DAP单体的化学方程式
25.(16分)
(1)① CH2=CHCH2Cl 碳碳双键、氧原子
② 取代反应
(2)CH2=CHCH2Cl+H2O CH2=CHCH2OH+HCl
(3)CH3COOCH2CH=CH2
(4)a c d
(5)蒸馏
(6)2 CH2=CHCH2OH+
26.(15分)
以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略);
I 从废液中提纯并结晶处FeSO4?7H2O
II将 溶液与稍过量的 溶液混合,得到含 的浊液
IV 将浊液过滤,用90°C热水洗涤沉淀,干燥后得到 固体
V煅烧 ,得到 固体
已知: 在热水中分解
(1) I中,加足量的铁屑出除废液中的 ,该反应的离子方程式是
(2) II中,需加一定量硫酸,运用化学平衡原理简述硫酸的作用
(3) III中,生成 的离子方程式是 。若 浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是 。
(4) IV中,通过检验 来判断沉淀是否洗涤干净。检验 操作是是 。
(5) 已知煅烧 的化学方程式是 ,现煅烧464.0kg的 ,得到316.8kg产品,若产品中杂质只有 ,则该产品中 的质量是 kg(摩尔质量26.(15分)
(1)Fe+2Fe3+=3Fe2+
(2)加入硫酸,H+浓度增大,使Fe2++2H2O Fe(OH)2+2H+的平衡向逆反应方向移动,从而抑制FeSO4的水解
(3)Fe2++2HCO3-=FeCO3↓+CO2↑+H2O
4 FeCO3+6H2O+O2=4Fe(OH)3↓+4CO2
(4)取少量洗涤后的滤液放入试管中,滴加酸化的BaCl2溶液,若无白色沉淀产生,则沉淀洗涤干净
(5)288.0/g? ; )
2009年全国29.(15分)
现有A、B、C、D、E、F六种化合物,已知它们的阳离子有K+、Ag+、Ca2+、Ba2+、Fe2+、Al3+,阴离子有Cl-、OH-、CH3COO-、NO3-、SO32-、CO32-,现将它们分别配成0.1 mol?L-1的溶液,进行如下实验:
① 测得溶液A、C、E呈碱性,且碱性为A>E>C;
② 向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;
③ 向D溶液中滴加Ba(NO3)2溶液,无明显现象;
④ 向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。
根据上述实验现象,回答下列问题:
(1)实验②中反应的化学方程式是 ;
(2)E溶液是 ,判断依据是 ;
(3)写出下列四种化合物的化学式:A ,C 29.(15分)
(1)AgNO3+NH3?H2O=AgOH↓+NH4NO3
AgOH+2NH3?H2O=Ag(NH3)2OH+2H2O
(2)碳酸钾 由①中碱性强弱的顺序可知,E是碳酸盐。六种阳离子中可以与碳酸根形成可溶性盐的只有钾离子,所以E是碳酸钾
(3)Ba(OH)2 Ca(CH3COO)2 AlCl3 FeSO4
29、(15分)
已知周期表中,元素Q、R、W、Y与元素X相邻。Y的最高化合价氧化物的水化物是强酸。回答下列问题:
(1)W与Q可以形成一种高温结构陶瓷材料。W的氯化物分子呈正四面体结构,W的氧化物的晶体类型是_________________;
(2)Q的具有相同化合价且可以相互转变的氧化物是_______________;
(3)R和Y形成的二价化合物中,R呈现最高化合价的化合物是化学式是___________;
(4)这5个元素的氢化物分子中,①立体结构类型相同的氢化物的沸点从高到低排列次序是(填化学式)___________________,其原因是___________________
②电子总数相同的氢化物的化学式和立体结构分别是________________________________________________________;
(5)W和Q所形成的结构陶瓷材料的一种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCl气体;W(QH2)4在高温下分解生成Q的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是
____________________________________
答案.(1)原子晶体。(2)NO2和N2O4(3)SO3。(4)①NH3>PH3,H2O>H2S,因为前者中含有氢键。②NH3和H2O分别为三角锥和V形;SiH4、PH3和H2S结构分别为正四面体,三角锥和V形。(5)SiCl4 + 4NH3 = Si(NH2)4 + 4HCl,3Si(NH2)4 = 8NH3 + Si3N4
解析本题可结合问题作答。W的氯化物为正四体型,则应为SiCl4或CCl4,又W与Q形成高温陶瓷,故可推断W为Si。(1)SiO2为原子晶体。(2)高温陶瓷可联想到Si3N4,Q为N,则有NO2与N2O4之间的相互转化关系。(3)Y的最高价氧化的的水化物为强酸,且与Si、N等相邻,则只能是S。Y为O,所以R的最高价化合物应为SO3。(4)显然D为P元素。①氢化物沸点顺序为NH3>PH3,H2O>H2S,因为前者中含有氢键。②NH3和H2O的电子数均为10,结构分别为三角锥和V形,SiH4、PH3和H2S的电子数均为18。,结构分别为正四面体,三角锥和V形。(5)由题中所给出的含字母的化学式可以写出具体的物质,然后配平即可。
2009年上海 30.臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压放电管来制取臭氧:
(1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为______g/mol
(保留一位小数)。
(2)将8L氧气通过放电管后,恢复到原状况,得到气体6.5L,其中臭氧为_____________L。
(3)实验室将氧气和臭氧的混合气体0.896L(标准状况)通入盛有20.0g铜粉的反应器中,充分加热后,粉末的质量变为21.6g。则原混合气中臭氧的体积分数为__________________。
31.烟气中 是NO和 的混合物(不含 )。
(1)根据废气排放标准, 烟气最高允许含400mg 。若 中NO质量分数为0.85,则 烟气中最高允许含NO__________L(标准状况,保留2位小数)。
(2)工业上通常用溶质质量分数为0.150的 水溶液(密度1.16g/mL)作为 吸收剂,该碳酸钠溶液物质的量浓度为____________mol/L(保留2位小数)。
(3)已知: ①
②
含2000mg 的烟气用质量分数为0.150的碳酸钠溶液吸收。若吸收率为80%,吸收后的烟气_______排放标准(填“符合”或“不符合”),理由:____________________。
(4)加入硝酸可改变烟气中NO和NO2的比,反应为:
NO+2HNO3→3NO2+H2O
当烟气中 时,吸收率最高。
烟气含2000mg ,其中 。
计算:(i)为了达到最高吸收率, 烟气需用硝酸的物质的量(保留3位小数)。
(ii) 烟气达到最高吸收率90%时,吸收后生成NaNO2的质量(假设上述吸收反应中,反应①比反应②迅速。计算结果保留1位小数)。
30.(本题共5分)
(1)35.6
(2)3
(3)0.5
31.(本题共11分)
(1)0.25w.w.w.k.s.5.u.c.o.m
(2)1.64
(3)不符合 因吸收后烟气总体积减小, 含量仍超过
(4)(i)
(ii)
2010年全国 28.(15分)有A、B、C、D、E和F六瓶无色溶液,他们都是中学化学中常用的无机试剂。纯E为无色油状液体;B、C、D和F是盐溶液,且他们的阴离子均不同。现进行如下实验:
①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾;
②将A分别加入其它五中溶液中,只有D、F中有沉淀产生;继续加入过量A时,D中沉淀无变化,F中沉淀完全溶解;
③将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出;
④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶。
根据上述实验信息,请回答下列问题:
(1) 能确定溶液是(写出溶液标号与相应溶质的化学式):
(2) 不能确定的溶液,写出其标号、溶质可能的化学式及进一步鉴别的方法:
解析(I)由题干表述可知A和E不是盐,又由纯E为无色油状液体,推知E为硫酸(③步操作进一步确定);(II)由题干和①步操作可知A为氨水; (III)再由②步操作可知F中阳离子为Ag+发生的反应为:Ag++NH3?H2O=AgOH↓+NH4+;AgOH+2NH3?H2O=[Ag(NH3)2]++OH-+2H2O;而常见的盐中只有AgNO3可溶于水,故F为AgNO3;(IV)由③步操作可知B中阴离子应为CO32-,由于此无色无味的气体只能是CO2, B、C、D中能生成沉淀说明不能是HCO3-,而阳离子可是常见的K+、Na+、NH4+等待定(V)同样由②步操作D中能与氨水生成沉淀的无色溶液中常见的为阳离子为Mg2+或Al3+,而阴离子需待下步反应再确定;(VI)由④步操作生成的沉淀为可能为AgCl、AgBr、AgI、BaSO4、H2SiO3(不合理)等,但限于题干所述中学常用试剂,则沉淀应为AgCl和BaSO4,才不溶于HNO3,一个是与AgNO3结合生成的沉淀,一个是与硫酸结合形成的沉淀,故C应该同时含有Ba2+和Cl-即,C为BaCl2,进而推出D中阴离子应该为SO42-,因为题干所述盐溶液中阴离子均不同,故D为Al2(SO4)3或MgSO4其他解析见答案
答案(1)A NH3?H2O或NH3 ;E H2SO?4 F AgNO3 C BaCl2
若C作为不能确定的溶液,进一步鉴别的方法合理,同样给分
(2)B Na2CO3或K2CO3 用洁净的铂丝蘸取少量B,在酒精灯火焰中灼烧,若焰色呈**则B为Na2CO3溶液;若透过蓝色钴玻璃观察焰色呈紫色,则B为K2CO3溶液
D Al2(SO4)3或MgSO4 取少量D,向其中滴加NaOH溶液有沉淀生成,继续滴加过量的NaOH溶液,若沉淀溶解,则D为Al2(SO4)3溶液,若沉淀不溶解,则D为MgSO4溶液
命题意图考查学生的分析与综合能力,涉及到无机元素及其化合物的性质,离子反应,未知物的推断,物质的检验,常见物质量多与量少的反应不同,现象不同等,此题综合性强,难度大,区分度很好,是一道不可多得的经典好题!
点评此题一改过去每年元素推断的通病,思维容量显著增大能力要求高,与2008年全国卷I理综28题有得一拼,比2009年的第29题出得高超一些,相比以前的无机推断显然有质的飞跃,看到命题人在进步!但是此题是不是一点瑕疵没有呢?x显然不是,例如本题条件很宽广,没太明显的限制条件,因而答案是丰富多彩的,这不会给阅卷者带来喜出望外,只会增加难度,不好统一评分标准,也就缺乏公平性!特别是B和C上就有争议,如B还可能是(NH4)2CO3,C还可能是BaBr2、BaI2等,当然限制一下沉淀颜色就排除了C的歧义!
2010年天津7.(14分)X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。
回答下列问题:
⑴ L的元素符号为________ ;M在元素周期表中的位置为________________;五种元素的原子半径从大到小的顺序是____________________(用元素符号表示)。
⑵ Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的电子式为___,B的结构式为____________。
⑶ 硒(se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为_______,其最高价氧化物对应的水化物化学式为_______。该族2 ~ 5周期元素单质分别与H2反应生成l mol气态氢化物的反应热如下,表示生成1 mol硒化氢反应热的是__________(填字母代号)。[来源:学科网]
a.+99.7 mol?L-1 b.+29.7 mol?L-1 c.-20.6 mol?L-1 d.-241.8 kJ?mol-1
⑷ 用M单质 作阳极,石墨作阴极,NaHC O3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q 。写出阳极生成R的电极反应式:______________;由R生成Q的化学方程式:_______________________________________________。
解析:(1)X、Y、Z、L是组成蛋白质的四种元素且原子序数依次增大,故分别为:H、C、N、O元素;M是地壳中含量最高的元素,为Al,其在周期表的位置为第3周第ⅢA族;再根据五种元素在周期表的位置,可知半径由大到小的顺序是:Al>C>N>O>H。
(2) N和H 1:3构成的分子为NH3,电子式为 ;2:4构成的分子为N2H4,其结构式为 。
(3)Se比O多两个电子层,共4个电子层,1→4电子层上的电子数分别为:2、8 、18、6,故其原子序数为34;其最高价氧化物对应的水化物的化学式类似H2SO4,为H2SeO4。
非金属性越强,与氢气反应放出的热量越多,故2→5周期放出的热量依次是:d、c、b、a,则第四周期的Se对应的是b。
(4)Al作阳极失去电子生成Al3+,Al3++3HCO3-==Al(OH)3+3CO2,2Al(OH)3 Al2O3+3H2O。
答案:
(1)O 第三周第ⅢA族 Al>C>N>O>H
(2)
(3) 34 H2SeO4 b
(4) Al-3e- Al3+ Al3++3HCO3-==Al(OH)3+3CO2 2Al(OH)3 Al2O3+3H2O。
命题立意:本题以元素的推断为背景,综合考查了元素符号的书写、元素位置的判断和原子半径大小的比较;考查了电子式、结构式的书写,元素周期律,和电极反应式、化学方程式的书写,是典型的学科内综合试题。
有图的这里大不了,对不起
福建2023年高考化学难吗?
可能用到的相对原子质量:H—1 C—12 O—16 S—32
第Ⅰ卷(选择题 共42分)
本部分共14个小题,每小题3分,每小题只有一项符合题目要求
1.2015年氰化物成为热议话题。氢氰酸的结构式为H─C ≡ N,则N元素的化合价为
A.–3 B.+1 C.+3 D.+5
2.化学与生活密切相联,下列应用中利用了物质的氧化性的是
A.SO2漂白纸浆 B.纯碱清洗油污 C.Na2S除污水中的Cu2+ D.漂白色粉末漂白织物
3.下列化学用语表示正确的是
A.聚丙烯的结构简式:
C.对羟基苯甲醛的结构简式:B.NH4Br的电子式: D.二氧化碳分子的比例模型:
4.钙和钠相似,也能形成过氧化物,则下列叙述正确的是( )
A.过氧化钙的化学式是Ca2O2
B.1mol过氧化钠或过氧化钙跟足量水反应都生成0.5mol氧气
C.过氧化钙中阴阳离子数之比为2:1
D.过氧化钙中只含离子键
5.部分短周期元素化合价与原子序数的关系可用右图
表示,下列说法正确的是
A.原子半径:Z>Y>X
B.X和Z形成的化合物能溶于NaOH溶液
C.Q和X形成的化合物不能与酸反应
D.R元素的含氧酸和W元素的含氧酸,酸性一定前者强
6.下列装置所示的分离提纯方法和物质的溶解性无关的是 .....
A. B.
C. D.
7.明代宋应星著的《天工开物》中有关于―火法‖冶炼锌的工艺记载:―炉甘石十斤,装载入一泥罐内,……然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,……,冷淀,毁罐取出,……,即倭铅也。‖下列说法不正确的是(注:炉甘石的主要成分为碳酸锌) ...
A.该冶炼锌的反应属于置换反应
B.煤炭中起作用的主要成分是C
C.冶炼Zn的反应方程式为:ZnCO3+2C
D.倭铅是指金属锌和铅的混合物
8.去甲肾上腺素可以调控动物机体的植物性神经功能,其结构简式如下图所示,下列说法正确的是
A.该有机物的分子式是C8H10NO3
B.1mol该有机物最多能与2molBr2发生反应
C.该有机物不能与Na2CO3溶液反应
D.该有机物既能与盐酸反应,又能与氢氧化钠溶液反应
9.下列指定微粒的数目相等的是
A.等质量的乙烯和丙烯中含有的共用电子对数
B.等物质的量的水与重水含有的中子数
C.同温、同压、同体积的CO和NO含有的质子数
D.等物质的量的铁和铝分别与足量盐酸完全反应时转移的电子数
10.根据下图,下列判断中正确的是
A.石墨与O2生成CO2的反应是吸热反应Zn+3CO↑
B.金刚石、石墨与O2反应,均可生成具有极性共价键的CO2
C.从能量角度看,金刚石比石墨更稳定
D.C(金刚石,s) === C(石墨,s) △H=E3—E1
11.溴酸银(AgBrO3)的溶解度随温度变化曲线如右上图所示,下列说法正确的是
A.温度升高不利于溴酸银的溶解
B.溴酸银的溶解是放热过程
C.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯
D.60 ℃时,将0.04g溴酸银加入到10g水中,形成的分散系中存在沉淀溶解平衡
12.常温下,两种酸的电离平衡常数如下表:
常温下,浓度均为0.1 mol/L的下列溶液:①Na2SO3;②Na2CO3;③NaHSO3,下列有关说法正确的是
A.pH:Na2CO3溶液小于Na2SO3溶液
B.结合H+能力:CO32ˉ弱于SO32ˉ
C.NaHSO3溶液显酸性的原因是: NaHSO3=== Na+ + H+ + SO32ˉ
D.①与②溶液等体积混合后的溶液中:c(SO32) > c(CO32) > c(HCO3) > c(HSO3) ----
13.某同学将光亮的镁条放入盛有NH4Cl溶液的试管中,有大量气泡产生。为探究其反应原理,该同学做了以下实验并观察到相关现象,由此得出的结论不合理
的是 ...
14.Na2FeO4是一种高效的水处理剂,下列用于解释事实的方程式中,不正确的是 ...
A.Na2FeO4消毒、杀菌时得到的Fe3+可以净水,Fe3+能产生净水物质的原因是: Fe3++3H2O Fe(OH)3(胶体)+3H+
B.工业上可用FeCl3、NaOH、NaClO三种物质反应制得Na2FeO4,化学方程式为: 2FeCl3+10NaOH+3NaClO === 2 Na2FeO4+9NaCl+5H2O
C.Na2FeO4在酸性溶液中不稳定,与水反应生成Fe3+和O2,离子方程式为:
4FeO42+10H2O === 4Fe3++20OH+3O2↑ --
D.工业上可用铁做阳极,电解浓NaOH溶液的方法制Na2FeO4,阳极的电极反应为: Fe-6e+8OH=== FeO42+4H2O ---
第Ⅱ卷(非选择题 共58分)
本部分共5小题,共58分。
15.(14分)高分子化合物PTT是一种性能优异的新型纤维,是当前国际上最新开发的热门高分子新材料。PTT的一种合成路线如下图:
(1)已知A→B是加成反应,B的结构简式为______,C分子中含有的官能团是_____。
(2)用系统命名法给有机物D进行命名_______________________________。
(3)芳香烃E的相对分子质量为106,E的一氯代物只有2种,则E的结构简式为___。
(4)E→F的反应类型为________反应,合成PTT的化学方程式为____________。
(5)有机物I的同分异构体有很多种,写出同时符合下列条件的所有同分异构体的结构简式____________________________________。
①含有苯环 ②核磁共振氢谱有三个峰
16.(9分)知识的梳理和感悟是有效学习的方法之一。某学习小组将有关―电解饱和食盐水‖的相关内容进行梳理,形成如下问题(显示的电极均为石墨)。
(1)图1中,电解一段时间后,气球b中的气体是______(填化学式),U形管_____(填―左‖或―右‖)边的溶液变红。
(2)利用图2制作一种环保型消毒液发生器,电解可制备―84‖消毒液的有
效成分,则c为电源的________极;该发生器中反应的总离子方程式为___________________。
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。该工艺的相关物质传输与转化关系如图3所示(其中的电极未标出,所用的离子膜都只允许阳离子通过)。
① 燃料电池B中的电极反应式分别为:负极_______________,正极______________。 ② 分析图3可知,氢氧化钠的质量分数a%、b%、c%由大到小的顺序为___________。 ....
17.(9分)铝及其化合物用途广泛,研究其性质具有重要意义。
参考答案:
1.化学方程式评分标准:
(1)化学(离子)方程式中,离子方程式写成化学方程式2分的给1分,1分的写对不给分。
(2)反应物、生成物化学式均正确得1分,有一种物质的化学式错即不得分。 (3)不写条件或未配平,按要求看是否扣分。 (4)不写“↑”或“↓”不扣分。
2.简答题中加点部分为给分点。 3.合理答案酌情给分。 15.(14分)(除特别注明,均每空2分) (1)CH3CHO(1分); -CHO、-OH (2)1,3-丙二醇
(3)
(4)取代(1分)。
(5)
(4分,写对1-2个1分,3个2分,4个3分,5-6个4分) 16.(9分))(除特别注明,均每空1分) .(1)H2 右
(2)负 Clˉ + H2O ClOˉ+ H2↑(2分)
(3)①2H2 – 4eˉ + 4OHˉ===4H2O O2 + 4eˉ + 2H2O === 4OHˉ
高三化学答案 1 / 2
电解
②b%>a%>c%(2分)
17.(9分)(除特别注明,均每空2分) (1)(1分)
(2)①2Al + 3H2O 一定条件 Al2O3 + 3H2↑ (条件不写不扣分)
②太阳能转变为电能,电能转化为化学能,化学能转变为热能
③2 H2O=== 2H2↑ + O2↑(文字表述也可以)
(3)Al(OH)3+NaOH===NaAlO2+ 2H2O(1分); c点开始主要是Al(OH)3溶于NaOH,生成显碱性的NaAlO(1分),体系是Al(OH)3和NaAlO2的混合,随着NaAlO2浓度的2.........增大,pH增大,该过程类似于酸碱中和,因此pH有突跃(说法合理答案均给分) 18.(14分)(每空2分)
(1) O3(g)+2I(aq)+2H(aq) ===I2(aq)+H2O(l)+O2(g) △H=△H 1+△H 2+△H 3 (2) ① 1.00×10-4 ②OH(3)B
(4)①I、I2、I3 ; ②在此温度下,.I2在KI溶液中的溶解性比在中强
③b a c
19.(12分)(除特别注明,均每空2分) I.(1)SO2(g) SO2+H2O
SO2 (aq)(不写不扣分); H2SO3 ; H2SO3(写对2个即可得分,其它写法正确也可以给分,如:SO2+xH2O+xH2O
H + SO32+(x-1)H2O) SO2?xH2O,SO2
(2)干白中二氧化硫或亚硫酸含量太少 II.(3)圆底烧瓶(1分) (4)SO2+H2O2===H2SO4(1分) (5)加入二氧化锰并振荡
(6)0.32 ; 盐酸的挥发造成的干扰 。
2023年福建省高考化学试题总体来说是比较难的。
虽然考的试题内容非常基础,但是题目创新性非常高,这给很多考生带来了不小的压力。福建高考化学试卷总体来说有难度,高考化学科试卷,坚持“以稳为主、稳中有变、稳中求新。
2023年福建高考化学试题难度如何
2023年福建省高考化学试题总体来说是比较难的。化学试题难不难想必一定是考生讨论的热门话题,有的人觉得难,有的人觉得不难。
福建高考化学还是比较难的,虽然考的试题内容非常基础,但是题目创新性非常高,这给很多考生带来了不小的压力。
今年高考命题将保持试卷结构、题型题量以及考试难度的相对稳定。今年高考是疫情防控常态化下的高考,同时也是高考改革深入推进形势下的一次高考,今年的高考命题重点从铸魂育人、落实改革、确保稳定三个方面开展。
2023福建高考化学试卷的难度解析
福建高考化学试卷总体来说有难度,高考化学科试卷,坚持“以稳为主、稳中有变、稳中求新、平稳推动”的根本原则,力求反映高中新课程理念,力求使试题命制在科学性与标准性、难度与区分度、公正性与合理性等方面相统一。
2023福建高考化学试卷难度单单从试卷的试题本身来说,这个和每个人的知识点掌握程度和擅长的题目类型有关系,还和个人的临场发挥有关联,高考考生现场状态非常重要。
拓展知识:
对于化学知识的联系和拓展也非常重要,需要学生灵活掌握系统化的解题思路,培养自己逻辑思维的能力,吸收更多的实际经验和知识,不断将学到的知识融汇贯通,并且能够理清技巧和方法与理论之间的关系。
考虑到化学等级考对高校招生入学的影响,2023年的化学等级考难度相对会更高。因此,同学们在备考时一定要认真复习所学知识,注重提高综合应用能力,保持练习和思考的频率,同时要注意掌握好考试过程中的答题技巧和方法。
下一篇:高考重新填志愿,重填高考志愿









